Quantitative Susceptibility Mapping (QSM) ist ein biomedizinische Bildgebungsverfahren mit vielseitigen Anwendungen für die Hirnvorschung
Dr. Stephane ROCHE, PhD, Dr. Ludovic de ROCHEFORT, PhD; November 2022
Definition: QSM (Quantitative Susceptibility Mapping) ist ein fortschrittliches biomedizinisches Bildgebungsverfahren für die Forschung, basierend auf Magnetischer Resonanz Tommographie (MRT)1,2. Die QSM-Technologie erlaubt es die Intensität und Position magnetischcher Quellen im Gewebe zu identfizieren, mithilfe der MRT gestützten Kartierung des magnetischen Felds. Das Verfahren ist daher nicht-invasiv und unterliegt denselben Einschränkungen wie jede MRT-Untersuchung. Die Durchführung dieser Untersuchung kann manchmal einige Minuten länger im MRT-Gerät erfordern. Die QSM-Technik wird hauptsächlich für die Bildgebung des Gehirns im Rahmen von präklinischen und klinischen Forschungsprotokollen verwendet, um zusätzliche Messungen zur Standardbildgebung zu liefern.
Abbildung 1: Quantifizierung toxischer Akkumulationen von Eisennanokristallen durch Quantifizierung der magnetischen Suszeptibilität (QSM)
Wissenschaftlicher Hintergrund: Mit dieser Technologie können Eisenansammlungen im Gehirn nachgewiesen werden (Abbildung 1). Eisen ist das am häufigsten vorkommende Metall der Erde und kommt in seinen beiden Ionenzuständen Fe(II) und Fe(III) in freier Form und als Oxid im Körper vor. Es ist an zahlreichen physiologischen Mechanismen beteiligt, wie dem Sauerstofftransport im Hämoglobin, dem Energiestoffwechsel, der DNA-Synthese, der Produktion von Neurotransmittern und deren Regulierung sowie anderen enzymatischen Prozessen. Intrazerebrales Eisen ist auch an der Bildung und Aufrechterhaltung neuronaler Netzwerke beteiligt 3–5 und ist entscheidend für die Bildung und Reparatur der Myelinscheide 6–10.
Eine abnormale Eisenanreicherung ist toxisch und führt zur Bildung freier Radikale und zu oxidativem Stress, der den Tod von Nervenzellen auslöst, ohne dass der Apoptose-Mechanismus greift. Dieser eiseninduzierte Zelltod wurde als Ferroptose 11–13 bezeichnet. Die toxische Anhäufung von Eisennanokristallen, die mit der Ferritinstruktur kombiniert sind, hat eine Größe von etwa 10 nm 14,15. Diese Nanokristalle haben eine pseudoenzymatische Aktivität, die reaktive Sauerstoffspezies erzeugt16–19.
Biophysikalische Hintergründe: Die Anreicherung von Eisen in Form von Nanokristallen geht mit einer Änderung des Magnetismus der zugehörigen Eisenoxide einher. Die labilen ionischen Formen des Eisens, die in der normalen Physiologie eine Rolle spielen, sind mit dem MRT nur schwach nachweisbar. Andererseits sind Eisenansammlungen in Oxidform in einigen Fällen paramagnetisch20,21, verändern das umgebende Magnetfeld und induzieren starke lokale magnetische Effekte, die durch eine Änderung der Magnetisierungsfähigkeit (magnetische Suszeptibilität) gekennzeichnet sind. Die QSM-Technologie ermöglicht es, diese Effekte aufzuspüren, sie zu lokalisieren und die mit der magnetischen Suszeptibilität verbundenen Signale zu quantifizieren, insbesondere im Bereich des Gehrins (Abbildung 2).
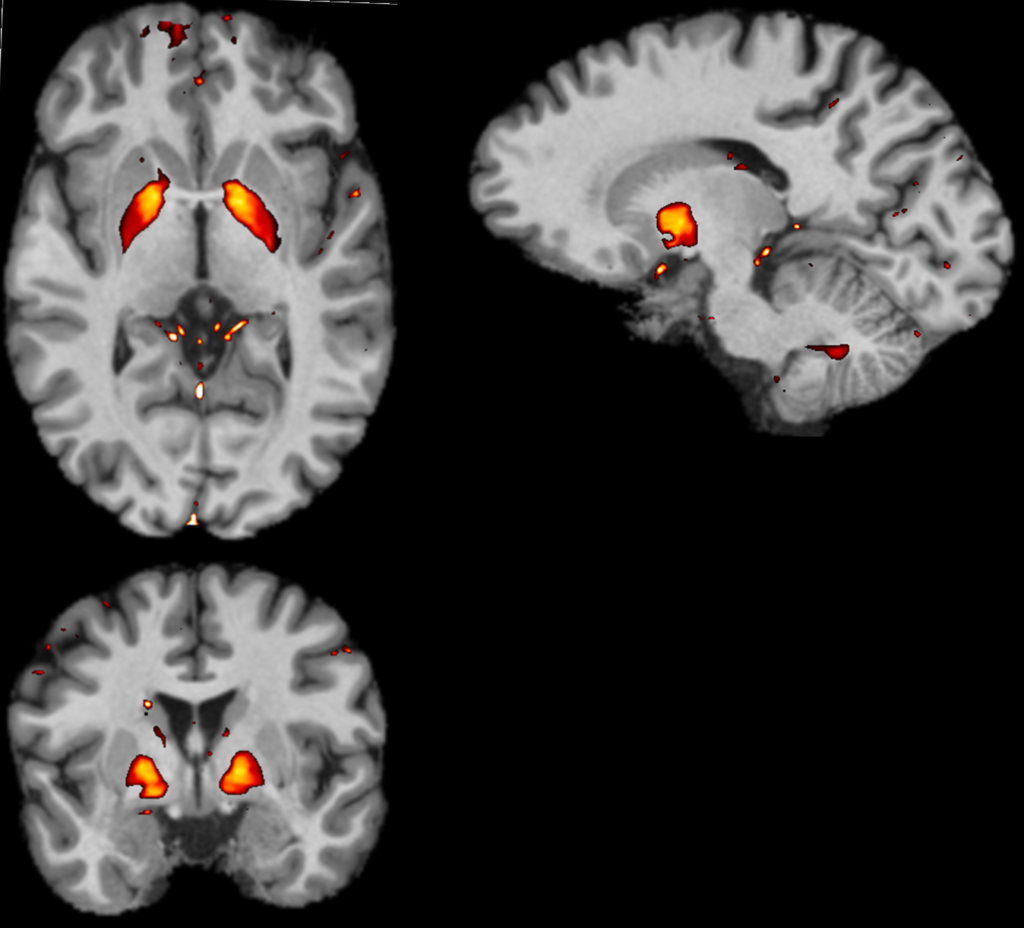
Abbildung 2: Axiale, sagittale und koronale Schnitte des Gehirns ermittelt mit Hilfe von MRT-Messungen und QSM-Signalen (mit freundlicher Genehmigung von CRMBM/CNRS UMR7339)
Diese Technologie, die ursprünglich von der Cornell University22,23 vorgeschlagen wurde, wurde miterfundenvom Gründer von Ventio. Ventio ist der exklusive Vertreiber von QSMetric für die Forschung in Europa im Software-as-a-Service (SaaS) Modus. Die QSM-Technologie wurde wissenschaftlich und technisch erheblich weiterentwickelt, so dass sie unabhängig vom MRT-Gerät eingesetzt werden kann, in multizentrischen Studien robust ist 24–28 und für MRT von 1,5T bis 7T angewendet werden kann 26,29–31. Um optimal zu sein, erfordert die Technologie die Hinzufügung einer spezifischen T2*-3D-Multiecho-GRE-Sequenz, ähnlich einer suszeptibilitätsgewichteten Bildgebungssequenz32 (eng.: SWI), in der die Phasenbilder erfasst und gespeichert werden müssen, um die Rekonstruktion der QSM-Bilder zu ermöglichen.
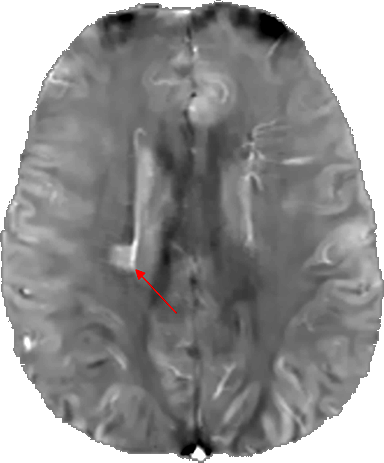
Abbildung 3: QSM-Gehirnbild (axiale Schicht) eines Patienten mit Multipler Sklerose. Der rote Pfeil zeigt die Läsion an. (Mit freundlicher Genehmigung von MIM – MedImageMetric LLC)
Biomedizinische Hintergründe: Es besteht ein starker wissenschaftlicher Zusammenhang zwischen Eisenakkumulation, Hirnalterung und der Entwicklung von neurodegenerativen Erkrankungen 33. Eisenanhäufungen in geschädigten Bereichen des Gehirns werden mit einer toxischen Anhäufung von Proteinen in Verbindung gebracht, wie z. B. die Ablagerung von Aβ-Peptiden und Tau-/PhosphoTau-Proteinen bei der Alzheimer-Krankheit34–36, die Anhäufung von α-Synuclein bei der Parkinson-Krankheit und verwandten Demenzerkrankungen (Lewy-Körper-Demenz)37–39 oder die Anhäufung von Huntingtin bei der Huntington-Krankheit 40–42.
Abnormale Eisenverteilungen finden sich auch bei Krankheiten wie der Multiplen Sklerose (Abbildung 3), insbesondere in Verbindung mit Läsionen der weißen Substanz (White Matter Lesion), die möglicherweise mit einem mehr oder weniger ausgeprägten kognitiven Rückgang verbunden sind 43. Die mithilfe MRT und QSM sichtbar gemachte Veränderung der Eisenverteilung wird auch bei vaskulärer Demenz beobachtet44 und wird derzeit bei onkologischen Erkrankungen untersucht45. Vielversprechende groß angelegte Bevölkerungsstudien, bei denen QSM zur Entwicklung prädiktiver Biomarker eingesetzt wird, zeigen, wie ausgereift diese Technologie ist46. Eine klinische Studie über Hirnschäden im Zusammenhang mit den neuropsychiatrischen Folgen von long CoViD-19 zeigt das Potenzial der MRT in Kombination mit der QSM-Technologie, insbesondere für ihre multizentrische Robustheit 47.
Die Wettbewerbsvorteile von QSMetric: Die patentierte QSM-Technologie wird von der wissenschaftlichen Gemeinschaft im Bereich der Magnetresonanztomographie (MRT) weitgehend übernommen, wobei die Zahl der wissenschaftlichen Veröffentlichungen pro Jahr kontinuierlich steigt. Sie hat dazu beigetragen, eine Reihe von Fragen zu beantworten, die bei klinischen Forschungsprojekten auftreten. Da die Ergebnisse unabhängig vom Hersteller des MRT-Geräts sind, ist die Technologie daher in multizentrischen Studien an alle Zentren anpassbar. QSMetric ist auf Standardgeräten mit 1,5 und 3 T anwendbar, aber auch auf Ultrahochfeldgeräten mit 7 T24,31.
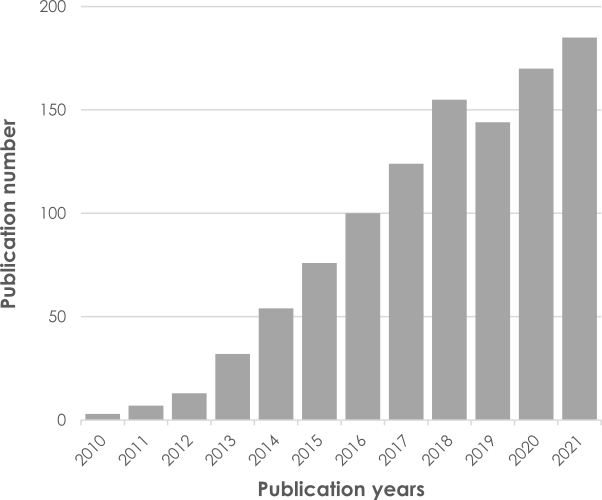
Abbildung 4: Annahme der QSM-Technologie durch die wissenschaftliche Gemeinschaft und Anstieg der jährlichen Häufigkeit von Veröffentlichungen in PubMed mit den Stichworten “Quantitative Susceptibility Mapping”.
Die Ergebnisse an 3-Tesla-Geräten (3T) sind sehr robust und reproduzierbar25,26,29. Die QSMetric-Technologie hat eine FDA-Freigabe für die Vormarktzulassung in den USA48.
In Europe, this technology is deployed by the company Ventio, which offers licenses in SaaS mode for research applications. It is an innovative advanced processing to be integrated into multicentric studies alongside more traditional biomarkers. Our team is currently working to create research partnerships on the applications of this technology.
In Europa wird diese Technologie von der Firma Ventio angeboten, die Lizenzen im SaaS-Modus für Forschungsanwendungen anbietet. Es handelt sich um ein innovatives fortschrittliches Verfahren, das neben den herkömmlichen Biomarkern in multizentrische Studien integriert werden kann. Unser Team arbeitet derzeit an der Gründung von Forschungspartnerschaften für die Anwendungen dieser Technologie.
Die biomedizinische Bildgebungstechnologie QSM (Quantitative Susceptibility Mapping) ist ein robuster und quantitativer Biomarker für intrazerebrales Eisen und kann die Wettbewerbsfähigkeit von Forschungsstudien über Ferroptose und die damit verbundenen neurodegenerativen Mechanismen erheblich steigern. Die von Ventio vertriebene QSMetric-Technologie ist herstellerübergreifend reproduzierbar und daher ideal für Ihre multizentrischen Studien. Dank des SaaS-Modus in einer sicheren Cloud kann die Technologie zur Verarbeitung von Daten aus bereits gebildeten oder im Aufbau befindlichen Kohorten eingesetzt werden.
Kontaktieren Sie uns für ein individuelles Angebot oder eine Partnerschaft!
Literaturverzeichnis
- Wang, Y., de Rochefort, L., Liu, T. & Kressler, B. Magnetic source MRI: a new quantitative imaging of magnetic biomarkers. Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. IEEE Eng. Med. Biol. Soc. Annu. Int. Conf. 2009, 53–56 (2009).
- de Rochefort, L. et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn. Reson. Med. 63, 194–206 (2010).
- Cecilia, A. et al. Cognitive control inhibition networks in adulthood are impaired by early iron deficiency in infancy. NeuroImage Clin. 35, 103089 (2022).
- Vallée, L. Fer et neurodéveloppement. Arch. Pédiatrie 24, 5S18-5S22 (2017).
- Georgieff, M. K. The role of iron in neurodevelopment: fetal iron deficiency and the developing hippocampus. Biochem. Soc. Trans. 36, 1267–1271 (2008).
- Shin, J. A. et al. Iron released from reactive microglia by noggin improves myelin repair in the ischemic brain. Neuropharmacology 133, 202–215 (2018).
- Cheli, V. T. et al. H-ferritin expression in astrocytes is necessary for proper oligodendrocyte development and myelination. Glia 69, 2981–2998 (2021).
- Mietto, B. S., Jhelum, P., Schulz, K. & David, S. Schwann Cells Provide Iron to Axonal Mitochondria and Its Role in Nerve Regeneration. J. Neurosci. 41, 7300–7313 (2021).
- Wan, R. et al. Impaired Postnatal Myelination in a Conditional Knockout Mouse for the Ferritin Heavy Chain in Oligodendroglial Cells. J. Neurosci. 40, 7609–7624 (2020).
- Lee, N. J. et al. Potential role of iron in repair of inflammatory demyelinating lesions. J. Clin. Invest. 129, 4365–4376 (2019).
- Dixon, S. J. et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell 149, 1060–1072 (2012).
- Masaldan, S., Bush, A. I., Devos, D., Rolland, A. S. & Moreau, C. Striking while the iron is hot: Iron metabolism and ferroptosis in neurodegeneration. Free Radic. Biol. Med. 133, 221–233 (2019).
- Yan, H. et al. Ferroptosis: mechanisms and links with diseases. Signal Transduct. Target. Ther. 6, 1–16 (2021).
- Alekseenko, A. V., Waseem, T. V. & Fedorovich, S. V. Ferritin, a protein containing iron nanoparticles, induces reactive oxygen species formation and inhibits glutamate uptake in rat brain synaptosomes. Brain Res. 1241, 193–200 (2008).
- Theil, E. C., Matzapetakis, M. & Liu, X. Ferritins: iron/oxygen biominerals in protein nanocages. JBIC J. Biol. Inorg. Chem. 11, 803–810 (2006).
- Honarmand Ebrahimi, K., Bill, E., Hagedoorn, P.-L. & Hagen, W. R. The catalytic center of ferritin regulates iron storage via Fe(II)-Fe(III) displacement. Nat. Chem. Biol. 8, 941–948 (2012).
- Honarmand Ebrahimi, K., Hagedoorn, P.-L. & Hagen, W. R. Unity in the biochemistry of the iron-storage proteins ferritin and bacterioferritin. Chem. Rev. 115, 295–326 (2015).
- Watt, R. K. A unified model for ferritin iron loading by the catalytic center: implications for controlling ‘free iron’ during oxidative stress. Chembiochem Eur. J. Chem. Biol. 14, 415–419 (2013).
- Gao, L., Fan, K. & Yan, X. Iron Oxide Nanozyme: A Multifunctional Enzyme Mimetic for Biomedical Applications. Theranostics 7, 3207–3227 (2017).
- Svobodova, H. et al. Iron-oxide minerals in the human tissues. Biometals Int. J. Role Met. Ions Biol. Biochem. Med. 33, 1–13 (2020).
- Vroegindeweij, L. H. P. et al. Quantification of different iron forms in the aceruloplasminemia brain to explore iron-related neurodegeneration. NeuroImage Clin. 30, 102657 (2021).
- de Rochefort, L. et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn. Reson. Med. 63, 194–206 (2010).
- de Rochefort, L., Brown, R., Prince, M. R. & Wang, Y. Quantitative MR susceptibility mapping using piece-wise constant regularized inversion of the magnetic field. Magn. Reson. Med. 60, 1003–1009 (2008).
- Spincemaille, P. et al. Clinical Integration of Automated Processing for Brain Quantitative Susceptibility Mapping: Multi-Site Reproducibility and Single-Site Robustness. J. Neuroimaging Off. J. Am. Soc. Neuroimaging 29, 689–698 (2019).
- Lancione, M. et al. Multi-centre and multi-vendor reproducibility of a standardized protocol for quantitative susceptibility Mapping of the human brain at 3T. Phys. Med. 103, 37–45 (2022).
- Deh, K. et al. Multicenter reproducibility of quantitative susceptibility mapping in a gadolinium phantom using MEDI+0 automatic zero referencing. Magn. Reson. Med. 81, 1229–1236 (2019).
- Rua, C. et al. Multi-centre, multi-vendor reproducibility of 7T QSM and R2* in the human brain: Results from the UK7T study. NeuroImage 223, 117358 (2020).
- Lancione, M. et al. Echo-time dependency of quantitative susceptibility mapping reproducibility at different magnetic field strengths. NeuroImage 197, 557–564 (2019).
- Deh, K. et al. Reproducibility of quantitative susceptibility mapping in the brain at two field strengths from two vendors. J. Magn. Reson. Imaging 42, 1592–1600 (2015).
- Ippoliti, M. et al. Quantitative susceptibility mapping across two clinical field strengths: Contrast-to-noise ratio enhancement at 1.5T. J. Magn. Reson. Imaging JMRI 48, 1410–1420 (2018).
- Spincemaille, P. et al. Quantitative Susceptibility Mapping: MRI at 7T versus 3T. J. Neuroimaging Off. J. Am. Soc. Neuroimaging 30, 65–75 (2020).
- Bian, W. et al. MR susceptibility contrast imaging using a 2D simultaneous multi-slice gradient-echo sequence at 7T. PLOS ONE 14, e0219705 (2019).
- Ravanfar, P. et al. Systematic Review: Quantitative Susceptibility Mapping (QSM) of Brain Iron Profile in Neurodegenerative Diseases. Front. Neurosci. 15, 618435 (2021).
- Ayton, S. et al. Brain iron is associated with accelerated cognitive decline in people with Alzheimer pathology. Mol. Psychiatry 25, 2932–2941 (2020).
- Cogswell, P. M. et al. Associations of quantitative susceptibility mapping with Alzheimer’s disease clinical and imaging markers. NeuroImage 224, 117433 (2021).
- Kim, H.-G. et al. Evaluation and Prediction of Early Alzheimer’s Disease Using a Machine Learning-based Optimized Combination-Feature Set on Gray Matter Volume and Quantitative Susceptibility Mapping. Curr. Alzheimer Res. 17, 428–437.
- Duce, J. A. et al. Post translational changes to α-synuclein control iron and dopamine trafficking; a concept for neuron vulnerability in Parkinson’s disease. Mol. Neurodegener. 12, 45 (2017).
- Du, G. et al. Distinct progression pattern of susceptibility MRI in the substantia nigra of Parkinson’s patients. Mov. Disord. 33, 1423–1431 (2018).
- Thomas, G. E. C. et al. Brain iron deposition is linked with cognitive severity in Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry 91, 418–425 (2020).
- van Bergen, J. M. G. et al. Quantitative Susceptibility Mapping Suggests Altered Brain Iron in Premanifest Huntington Disease. Am. J. Neuroradiol. 37, 789–796 (2016).
- Kinnunen, K. M. et al. Volumetric MRI-Based Biomarkers in Huntington’s Disease: An Evidentiary Review. Front. Neurol. 12, 712555 (2021).
- Lavrador, R., Júlio, F., Januário, C., Castelo-Branco, M. & Caetano, G. Classification of Huntington’s Disease Stage with Features Derived from Structural and Diffusion-Weighted Imaging. J. Pers. Med. 12, 704 (2022).
- Huang, W. et al. Quantitative susceptibility mapping captures chronic multiple sclerosis rim lesions with greater myelin damage: Comparison with high-pass filtered phase MRI. http://medrxiv.org/lookup/doi/10.1101/2021.05.23.21257680 (2021) doi:10.1101/2021.05.23.21257680.
- Moon, Y., Han, S.-H. & Moon, W.-J. Patterns of Brain Iron Accumulation in Vascular Dementia and Alzheimer’s Dementia Using Quantitative Susceptibility Mapping Imaging. J. Alzheimers Dis. 51, 737–745 (2016).
- Reith, T. P. et al. Basal Ganglia Iron Content Increases with Glioma Severity Using Quantitative Susceptibility Mapping: A Potential Biomarker of Tumor Severity. Tomography 8, 789–797 (2022).
- Wang, C. et al. Phenotypic and genetic associations of quantitative magnetic susceptibility in UK Biobank brain imaging. Nat. Neurosci. 25, 818–831 (2022).
- Duff, E. et al. Reliability of multi-site UK Biobank MRI brain phenotypes for the assessment of neuropsychiatric complications of SARS-CoV-2 infection: The COVID-CNS travelling heads study. PLOS ONE17, e0273704 (2022)
- 510(k) Premarket Notification. 510(k) Number vol. K210415 (2021).