La quantification de la susceptibilité magnétique QSM, une technologie d’imagerie biomédicale aux multiples applications pour la recherche sur le cerveau
Dr. Stephane ROCHE et Dr. Ludovic de ROCHEFORT, Novembre 2022
Définition : QSM pour « Quantitative Susceptibility Mapping » (Quantification de Susceptibilité Magnétique) est une technique d’imagerie biomédicale avancée pour la recherche, basée sur l’Imagerie par Résonance Magnétique (IRM) 1,2. La technologie QSM permet d’identifier la position et l’intensité des sources magnétiques dans les tissus, à partir d’une cartographie du champ magnétique par IRM. La technologie QSM est donc non-invasive et présente les mêmes contraintes que tout examen par IRM. La réalisation de cet examen peut parfois demander quelques minutes de plus dans l’appareil d’IRM. Cette technique QSM est principalement utilisée pour l’imagerie du cerveau dans le cadre de protocoles de recherche précliniques et cliniques pour fournir des mesures complémentaires à l’imagerie standard.
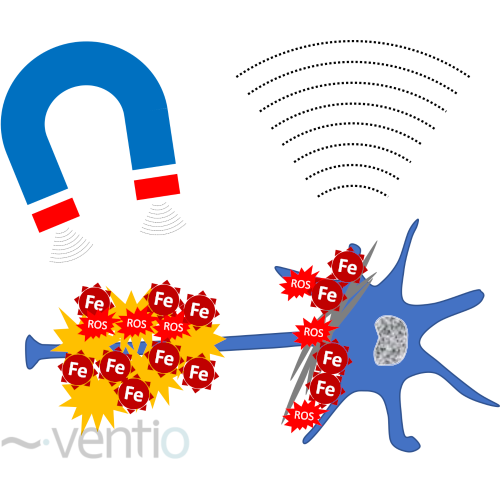
Figure 1: Représentation de principe de la quantification du magnétique de l’accumulation de nanocristaux de fer par quantification de la susceptibilité magnétique (QSM)
Rationnel scientifique : Cette technologie permet de détecter les accumulations du fer au niveau cérébral (figure 1). Le fer étant le métal le plus abondant sur terre, il est très présent dans l’organisme dans ses 2 états ioniques Fe(II) et Fe(III), sous forme libre et d’oxydes, et participe à de nombreux mécanismes physiologiques tel que le transport de l’oxygène dans l’hémoglobine, le métabolisme énergétique, la synthèse de l’ADN, la production des neurotransmetteurs et leur régulation ainsi que d’autres processus enzymatiques. Le fer intracérébral est aussi impliqué dans la formation et le maintien des réseaux neuronaux 3–5 et est essentiel pour la formation et la réparation de la gaine de myéline 6–10.
L’accumulation anormale de fer est toxique, provoquant la formation radicaux libres et un stress oxydatif induisant la mort neuronale, sans passer par les mécanismes d’apoptose. Cette mort cellulaire impliquant le fer a été nommée ferroptose 11–13. On observe l’accumulation toxique de nanocristaux de fer d’une taille de l’ordre de 10nm dans des structures associant la ferritine 14,15. Ces nanocristaux ont une activité pseudo-enzymatique produisant des espèces réactives de l’oxygène 16–19.
Rationnel biophysique : L’accumulation de fer sous forme de nanocristaux s’accompagne d’une modification du magnétisme des oxydes de fer associés. Les formes ioniques du fer, labiles, impliquées dans la physiologie normale sont très faiblement détectables par IRM. En revanche, les accumulations de fer sous forme d’oxydes sont, pour certaines, paramagnétiques 20,21, modifient le champ magnétique environnant et induisent localement de fort effets magnétiques, caractérisés par un changement de la capacité à s’aimanter (la susceptibilité magnétique). La technologie QSM permet de détecter ces effets, les positionner et quantifier les signaux liés à la susceptibilité magnétique, en particulier au niveau cérébral (figure 2).
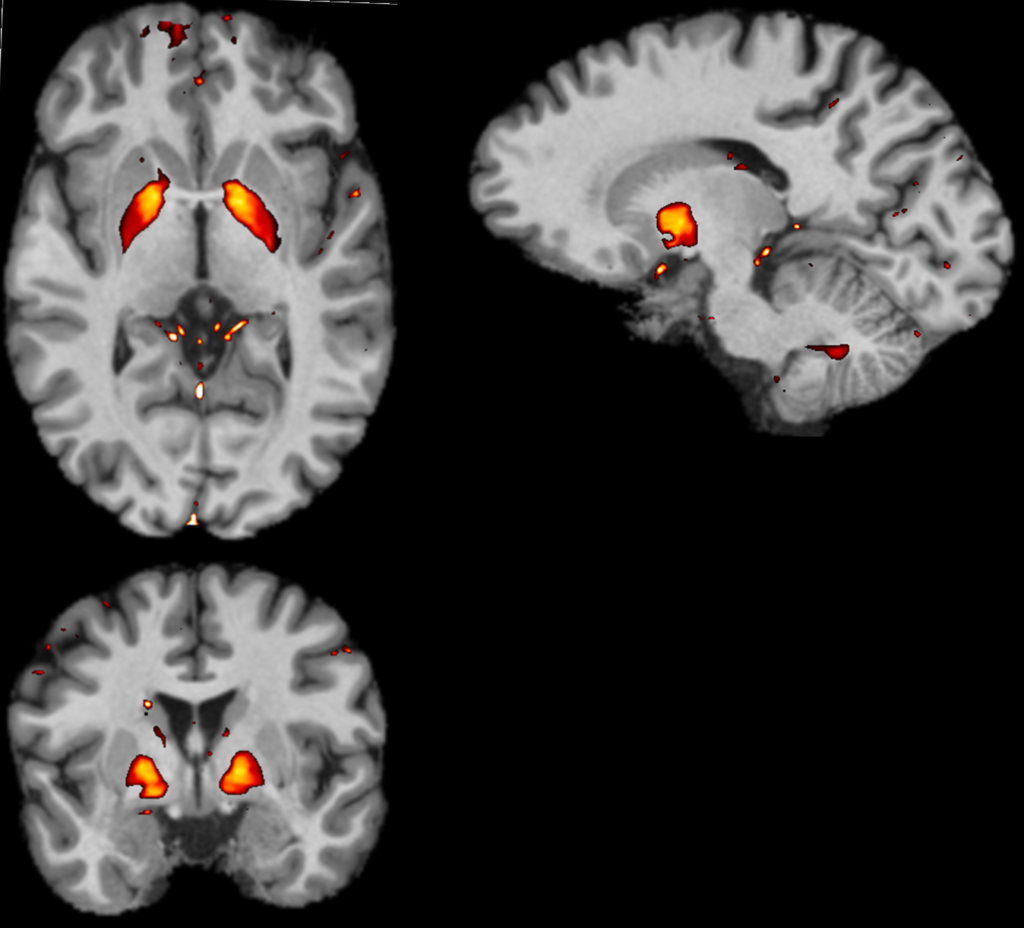
Figure 2: Coupes axiales, sagittale et coronale du cerveau par IRM et superposition des signaux QSM (Aimable autorisation du CRMBM/CNRS UMR7339)
Cette technologie, proposée initialement par l’université de Cornell 22,23 a pour co-inventeur le fondateur de Ventio, société distributrice exclusive de QSMetric pour la recherche en Europe en mode Software-as-a-Service (SaaS). Cette technologie a fait l’objet d’un développement scientifique et technique important permettant de proposer une technologie indépendante de l’appareil d’IRM, et par conséquent robuste dans les études multicentriques 24–28 et pouvant être appliquée à des IRM de 1,5T à 7T 26,29–31. La technologie nécessite, pour être optimale, l’ajout d’une séquence pondérée T2* 3D GRE en multi-écho disponible par défaut sur les machines, similaire à la séquence servant pour l’imagerie pondérée en susceptibilité SWI 32, et dans laquelle les images de phase doivent être acquises et stockées afin de réaliser la reconstruction des images QSM.
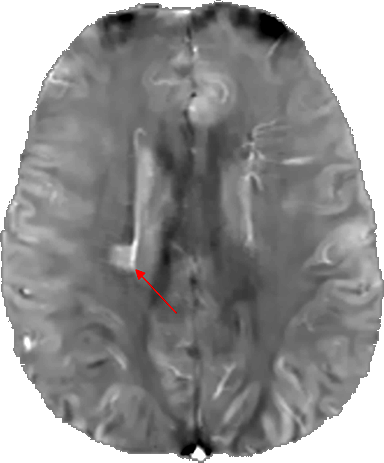
Figure 3: Imagerie cérébrale QSM (coupe axiale) du cerveau d’un patient atteint de sclérose en plaque. La flèche rouge indique la lésion. Aimable autorisation de MIM – MedImageMetric LLC
Rationnel biomédical : Il existe un rationnel scientifique fort entre accumulation de fer, vieillissement cérébral et l’évolution de pathologies neurodégénératives 33. On retrouve des accumulations de fer dans les zones lésées du cerveau, en lien avec l’accumulation toxique de protéines, tel que le dépôt des peptides Aβ et des protéines Tau / phosphoTau dans la maladie d’Alzheimer 34–36, de l’accumulation d’α-synucléine dans la maladie de Parkinson et démences apparentées (démences à corps de Lewy) 37–39 ou l’accumulation huntingtine dans la maladie de Huntington 40–42. On retrouve aussi des distributions anormales de fer dans des maladies comme la sclérose en plaques (figure 3) en particulier colocalisées avec les lésions de la matière blanche, potentiellement liée à un déclin cognitif plus ou moins marqué 43.
La modification de la distribution de fer visualisée par IRM et QSM est aussi objectivée dans les démences vasculaires 44 et est à l’étude dans des pathologies d’origine oncologique 45. Des études populationnelles de grande taille à fort potentiel utilisant QSM pour développer des biomarqueurs prédictifs montre la maturité de cette technologie 46. De façon intéressante, une étude clinique sur les atteintes cérébrales liées aux conséquences neuropsychiatriques du CoViD-19 long montre le potentiel de l’IRM et de la technologie QSM, en particulier pour sa robustesse multicentrique 47.
Les avantages compétitifs de QSMetric : la technologie brevetée QSM est très largement adoptée par la communauté scientifique en IRM avec une augmentation continue des publications scientifiques par an. Elle a permis de répondre à un certain nombre de questions rencontrées dans les projets de recherche clinique. Les résultats étant indépendants du constructeur de l’appareil d’IRM, elle est donc adaptable à tous les centres dans des études multicentriques. Elle est applicable sur les appareils standards de 1,5 et 3T, mais également sur les appareils à ultra-haut champ de 7T 24,31. Les résultats sur des appareils de 3 Tesla (3T) sont très robustes et reproductibles 25,26,29.
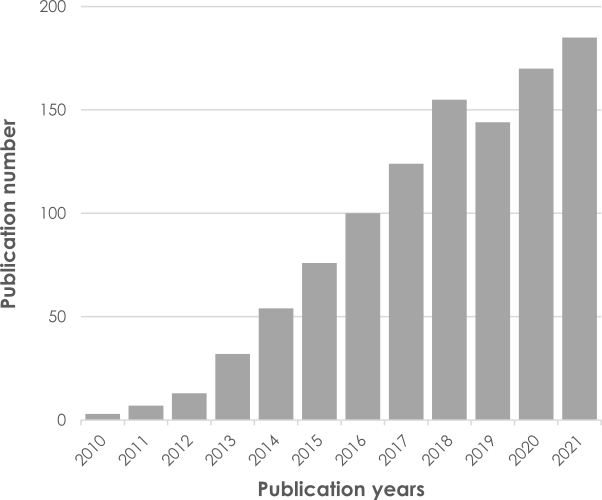
Figure 4: Adoption par la communauté scientifique de la technologie QSM et augmentation de la fréquence annuelle de publications dans PubMed avec les mots clés « Quantitative Susceptibility Mapping ».
La technologie QSMetric dispose d’une préautorisation de mise sur le marché aux USA par la FDA (FDA-clearance, premarket authorization) 46. En Europe, cette technologie est déployée par la société Ventio qui propose des licences en mode SaaS pour des applications de recherche. C’est un dispositif avancé innovant à intégrer dans des études multicentriques au côté de biomarqueurs plus classiques. Notre équipe œuvre actuellement pour créer des partenariats de recherche sur les applications de cette technologie.
La technologie d’imagerie biomédicale QSM (Quantification de la Susceptibilité Magnétique, Quantitative Susceptibility Mapping) est un biomarqueur robuste et quantitatif du fer intracérébral et peut significativement augmenter la compétitivité des études de la ferroptose et des mécanismes neurodégénératifs associés. La technologie QSMetric distribuée par Ventio est reproductible, multi-champ, multi-constructeur, et par conséquent idéale pour vos études multicentriques. Grace à son mode SaaS sur cloud sécurisé, la technologie s’interface pour traiter les données de cohortes déjà constituées ou en cours de constitution.
Contactez-nous pour une offre commerciale ou un partenariat !
Bibliographie
- Wang, Y., de Rochefort, L., Liu, T. & Kressler, B. Magnetic source MRI: a new quantitative imaging of magnetic biomarkers. Annu. Int. Conf. IEEE Eng. Med. Biol. Soc. IEEE Eng. Med. Biol. Soc. Annu. Int. Conf. 2009, 53–56 (2009).
- de Rochefort, L. et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn. Reson. Med. 63, 194–206 (2010).
- Cecilia, A. et al. Cognitive control inhibition networks in adulthood are impaired by early iron deficiency in infancy. NeuroImage Clin. 35, 103089 (2022).
- Vallée, L. Fer et neurodéveloppement. Arch. Pédiatrie 24, 5S18-5S22 (2017).
- Georgieff, M. K. The role of iron in neurodevelopment: fetal iron deficiency and the developing hippocampus. Biochem. Soc. Trans. 36, 1267–1271 (2008).
- Shin, J. A. et al. Iron released from reactive microglia by noggin improves myelin repair in the ischemic brain. Neuropharmacology 133, 202–215 (2018).
- Cheli, V. T. et al. H-ferritin expression in astrocytes is necessary for proper oligodendrocyte development and myelination. Glia 69, 2981–2998 (2021).
- Mietto, B. S., Jhelum, P., Schulz, K. & David, S. Schwann Cells Provide Iron to Axonal Mitochondria and Its Role in Nerve Regeneration. J. Neurosci. 41, 7300–7313 (2021).
- Wan, R. et al. Impaired Postnatal Myelination in a Conditional Knockout Mouse for the Ferritin Heavy Chain in Oligodendroglial Cells. J. Neurosci. 40, 7609–7624 (2020).
- Lee, N. J. et al. Potential role of iron in repair of inflammatory demyelinating lesions. J. Clin. Invest. 129, 4365–4376 (2019).
- Dixon, S. J. et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell 149, 1060–1072 (2012).
- Masaldan, S., Bush, A. I., Devos, D., Rolland, A. S. & Moreau, C. Striking while the iron is hot: Iron metabolism and ferroptosis in neurodegeneration. Free Radic. Biol. Med. 133, 221–233 (2019).
- Yan, H. et al. Ferroptosis: mechanisms and links with diseases. Signal Transduct. Target. Ther. 6, 1–16 (2021).
- Alekseenko, A. V., Waseem, T. V. & Fedorovich, S. V. Ferritin, a protein containing iron nanoparticles, induces reactive oxygen species formation and inhibits glutamate uptake in rat brain synaptosomes. Brain Res. 1241, 193–200 (2008).
- Theil, E. C., Matzapetakis, M. & Liu, X. Ferritins: iron/oxygen biominerals in protein nanocages. JBIC J. Biol. Inorg. Chem. 11, 803–810 (2006).
- Honarmand Ebrahimi, K., Bill, E., Hagedoorn, P.-L. & Hagen, W. R. The catalytic center of ferritin regulates iron storage via Fe(II)-Fe(III) displacement. Nat. Chem. Biol. 8, 941–948 (2012).
- Honarmand Ebrahimi, K., Hagedoorn, P.-L. & Hagen, W. R. Unity in the biochemistry of the iron-storage proteins ferritin and bacterioferritin. Chem. Rev. 115, 295–326 (2015).
- Watt, R. K. A unified model for ferritin iron loading by the catalytic center: implications for controlling ‘free iron’ during oxidative stress. Chembiochem Eur. J. Chem. Biol. 14, 415–419 (2013).
- Gao, L., Fan, K. & Yan, X. Iron Oxide Nanozyme: A Multifunctional Enzyme Mimetic for Biomedical Applications. Theranostics 7, 3207–3227 (2017).
- Svobodova, H. et al. Iron-oxide minerals in the human tissues. Biometals Int. J. Role Met. Ions Biol. Biochem. Med. 33, 1–13 (2020).
- Vroegindeweij, L. H. P. et al. Quantification of different iron forms in the aceruloplasminemia brain to explore iron-related neurodegeneration. NeuroImage Clin. 30, 102657 (2021).
- de Rochefort, L. et al. Quantitative susceptibility map reconstruction from MR phase data using bayesian regularization: validation and application to brain imaging. Magn. Reson. Med. 63, 194–206 (2010).
- de Rochefort, L., Brown, R., Prince, M. R. & Wang, Y. Quantitative MR susceptibility mapping using piece-wise constant regularized inversion of the magnetic field. Magn. Reson. Med. 60, 1003–1009 (2008).
- Spincemaille, P. et al. Clinical Integration of Automated Processing for Brain Quantitative Susceptibility Mapping: Multi-Site Reproducibility and Single-Site Robustness. J. Neuroimaging Off. J. Am. Soc. Neuroimaging 29, 689–698 (2019).
- Lancione, M. et al. Multi-centre and multi-vendor reproducibility of a standardized protocol for quantitative susceptibility Mapping of the human brain at 3T. Phys. Med. 103, 37–45 (2022).
- Deh, K. et al. Multicenter reproducibility of quantitative susceptibility mapping in a gadolinium phantom using MEDI+0 automatic zero referencing. Magn. Reson. Med. 81, 1229–1236 (2019).
- Rua, C. et al. Multi-centre, multi-vendor reproducibility of 7T QSM and R2* in the human brain: Results from the UK7T study. NeuroImage 223, 117358 (2020).
- Lancione, M. et al. Echo-time dependency of quantitative susceptibility mapping reproducibility at different magnetic field strengths. NeuroImage 197, 557–564 (2019).
- Deh, K. et al. Reproducibility of quantitative susceptibility mapping in the brain at two field strengths from two vendors. J. Magn. Reson. Imaging 42, 1592–1600 (2015).
- Ippoliti, M. et al. Quantitative susceptibility mapping across two clinical field strengths: Contrast-to-noise ratio enhancement at 1.5T. J. Magn. Reson. Imaging JMRI 48, 1410–1420 (2018).
- Spincemaille, P. et al. Quantitative Susceptibility Mapping: MRI at 7T versus 3T. J. Neuroimaging Off. J. Am. Soc. Neuroimaging 30, 65–75 (2020).
- Bian, W. et al. MR susceptibility contrast imaging using a 2D simultaneous multi-slice gradient-echo sequence at 7T. PLOS ONE 14, e0219705 (2019).
- Ravanfar, P. et al. Systematic Review: Quantitative Susceptibility Mapping (QSM) of Brain Iron Profile in Neurodegenerative Diseases. Front. Neurosci. 15, 618435 (2021).
- Ayton, S. et al. Brain iron is associated with accelerated cognitive decline in people with Alzheimer pathology. Mol. Psychiatry 25, 2932–2941 (2020).
- Cogswell, P. M. et al. Associations of quantitative susceptibility mapping with Alzheimer’s disease clinical and imaging markers. NeuroImage 224, 117433 (2021).
- Kim, H.-G. et al. Evaluation and Prediction of Early Alzheimer’s Disease Using a Machine Learning-based Optimized Combination-Feature Set on Gray Matter Volume and Quantitative Susceptibility Mapping. Curr. Alzheimer Res. 17, 428–437.
- Duce, J. A. et al. Post translational changes to α-synuclein control iron and dopamine trafficking; a concept for neuron vulnerability in Parkinson’s disease. Mol. Neurodegener. 12, 45 (2017).
- Du, G. et al. Distinct progression pattern of susceptibility MRI in the substantia nigra of Parkinson’s patients. Mov. Disord. 33, 1423–1431 (2018).
- Thomas, G. E. C. et al. Brain iron deposition is linked with cognitive severity in Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry 91, 418–425 (2020).
- van Bergen, J. M. G. et al. Quantitative Susceptibility Mapping Suggests Altered Brain Iron in Premanifest Huntington Disease. Am. J. Neuroradiol. 37, 789–796 (2016).
- Kinnunen, K. M. et al. Volumetric MRI-Based Biomarkers in Huntington’s Disease: An Evidentiary Review. Front. Neurol. 12, 712555 (2021).
- Lavrador, R., Júlio, F., Januário, C., Castelo-Branco, M. & Caetano, G. Classification of Huntington’s Disease Stage with Features Derived from Structural and Diffusion-Weighted Imaging. J. Pers. Med. 12, 704 (2022).
- Huang, W. et al. Quantitative susceptibility mapping captures chronic multiple sclerosis rim lesions with greater myelin damage: Comparison with high-pass filtered phase MRI. http://medrxiv.org/lookup/doi/10.1101/2021.05.23.21257680 (2021) doi:10.1101/2021.05.23.21257680.
- Moon, Y., Han, S.-H. & Moon, W.-J. Patterns of Brain Iron Accumulation in Vascular Dementia and Alzheimer’s Dementia Using Quantitative Susceptibility Mapping Imaging. J. Alzheimers Dis. 51, 737–745 (2016).
- Reith, T. P. et al. Basal Ganglia Iron Content Increases with Glioma Severity Using Quantitative Susceptibility Mapping: A Potential Biomarker of Tumor Severity. Tomography 8, 789–797 (2022).
- Wang, C. et al. Phenotypic and genetic associations of quantitative magnetic susceptibility in UK Biobank brain imaging. Nat. Neurosci. 25, 818–831 (2022).
- Duff, E. et al. Reliability of multi-site UK Biobank MRI brain phenotypes for the assessment of neuropsychiatric complications of SARS-CoV-2 infection: The COVID-CNS travelling heads study. PLOS ONE17, e0273704 (2022)
- 510(k) Premarket Notification. 510(k) Number vol. K210415 (2021).